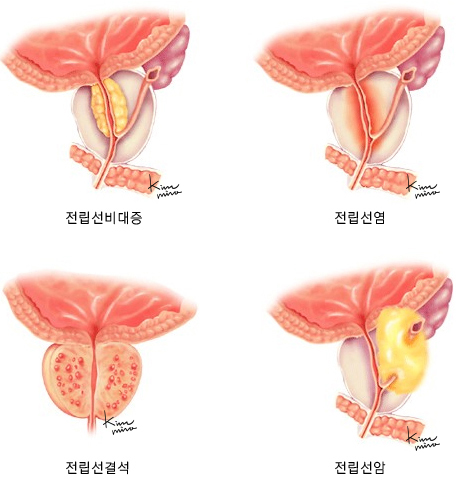
전립선암
정의 및 종류
정의
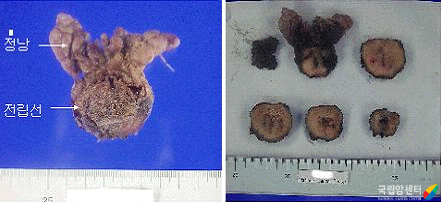
정상적인 세포는 일정 기간을 살면서 기능을 다하고는 사멸하지만, 어떤 경우에는 세포가 죽지 않고 계속 증식하여 종괴(腫塊, 덩이)를 형성하게 됩니다. 스스로의 분열과 성장‧사멸을 조절하는 세포 기능에 어떤 이유로든 고장이 생겼기 때문입니다. 이러한 덩이를 종양(腫瘍, tumor)이라고 하며 종양은 세포의 성장 속도가 느리고 다른 부위로 옮겨 가지 않는 양성 종양(benign tumor)과, 세포 성장이 빠르고 주위 조직과 다른 신체 부위로 퍼져 나가 생명까지 위협하는 악성 종양(malignant tumor)으로 나뉩니다. 전립선비대증 따위가 양성 종양이며, 전립선암은 악성 종양입니다.
전립선암 세포는 정상적인 통제에서 벗어나 계속 증식하면서 주변의 다른 조직으로 침윤(浸潤, 암세포가 인접한 조직에 파고드는 것)하기도 하고, 혈관이나 림프관을 통해 멀리 떨어진 조직으로 전이하기도 합니다. 전립선에서 발생하는 암의 대부분은 샘세포에서 발생하는 선암(腺癌, 샘암)입니다.
종류
전립선암의 조직학적 분류에서 주요 변수는 종양 조직의 분화 정도, 세포학적 이형성(異形成, dysplasia)의 정도, 세포핵의 이상 소견 등이고, 이런 요소들은 암의 임상적 예후와 밀접하게 연관됩니다. ‘이형성’이란 세포가 종양성으로 증식하는 것을 말하며, 종양 조직의 구조와 특성이 정상 조직과는 다른 데에서 온 표현입니다. 그리고 예후(豫後, prognosis)란 병의 상태가 앞으로 어떨지에 대한 전망, 혹은 병 치료 후의 경과를 말합니다.
종양 조직의 분화도(정상 조직과 비교한 세포의 분화 정도)를 분류하는 여러 방법 중에서는 예후를 잘 내다보게 해주는 글리슨 분류법(Gleason grading system)이 가장 널리 쓰입니다. 도널드 글리슨(Donald Gleason)이라는 병리학자가 제시한 이 방법은 약(弱)확대 현미경에서 보았을 때 나타나는 선(腺, gland 즉 샘)의 형태(architecture)를 분화도가 제일 좋은 1등급부터 가장 나쁜 5등급까지로 가르는 것입니다. 대개 전립선암은 하나의 종괴에서도 암세포의 분화가 균일하지 않으므로 가장 많이 나타나는 형태의 분화도와 둘째로 많이 나타나는 형태의 분화도를 종합하여 최종 등급을 매기며, 이를 글리슨 등급 또는 글리슨 점수(Gleason score)라고 합니다. 분화도가 좋을수록 예후가 좋은 편입니다.
글리슨 등급
| 등급 | 선의 형태 |
|---|---|
| 1등급 | 밀집하여 뭉쳐진, 하나의 분리된, 둥근, 단일 형태의 선(腺, 샘)들 : 종양의 경계가 잘 구분됨 |
| 2등급 | 하나의, 분리된, 둥근, 비교적 단일 형태의 선(腺)들로 한 개의 선 크기에 이르는 기질층에 분리됨 종양의 경계가 비교적 구분이 됨 |
| 3등급 | 하나의, 분리된, 여러 가지 크기의 불규칙적인 선(腺)들 : 체 모양 또는 유두상(유두 모양)의 종양으로, 경계가 불분명함 |
| 4등급 | 침습적인 코드의 융합된 선(腺)들을 지닌 종양으로 유두상, 체 모양 또는 고형의 작은 선들로 구성 : 세포는 작고 검거나 투명하다 |
| 5등급 | 면포 모양의 종양 배경에 선(腺)이 거의 없으며, 기질층을 침습하는 종양세포가 코드형 또는 판형으로 구성됨 |
글리슨 점수(Gleason score)=주된 형태의 글리슨 등급+보조적 형태의 글리슨 등급
글리슨 점수는 주된 형태와 보조적 형태의 점수를 합친 것이므로 최소값은 2, 최대값은 10입니다. 4 이하이면 분화도가 아주 좋은 것이고, 5~7은 중등도이며, 8 이상은 좋지 않은 것입니다. 7점 이상이라면 피막의 침범, 정낭(精囊, 정액을 생산하는 주머니) 침범, 절제 변연 양성(암 덩이를 적출한 절제면의 가장자리에 암세포가 남아 있음이 현미경 검사상 관찰되는 것), 림프절 전이 등의 의미 있는 예후 인자로 생각되어, 임상적으로 나쁜 분화도의 전립선암으로 봅니다.
전립선에 생기는 암의 95%는 관선방 분비상피(管腺房分泌上皮)에서 발생하는 선암이고, 5%는 이행상피암(移行上皮癌) 등이 차지하고 있습니다. 또한 선암의 85%가량은 앞에서 본 맥닐의 구역 분류에서 말초대(末梢帶)라고 한 부분에 발생합니다. 전립선에 생긴 전암성(前癌性) 변화를 ‘전립선 상피 내 신생물’이라고 하는데 이는 전립선암 환자의 약 3분의 1에서 발견됩니다. 그중 분화도가 나쁜 고악성도의 신생물은 침윤성 전립선암, 즉 인접 조직으로 번지는 성질을 지닌 암의 80%에서 발견되는 만큼, 전립선암의 전구(前驅) 병변으로 생각됩니다. 전구 병변 또는 전구 질환이란, 먼저 생긴 병변이 더 중대한 병으로 이어졌다고 판단되는 경우에 먼저 생긴 병변을 이르는 말입니다.
위험요인
위험요인
다른 암들과 마찬가지로 전립선암도 세포의 암적 변화를 억제하는 유전자의 기능이 떨어지고 암적 변화를 유도하는 유전자가 활성화되면 암세포가 형성됩니다. 이런 과정은 동물성 지방이 많은 육류를 과다하게 먹는 것에 의해서도 촉진될 수 있으며, 남성호르몬의 영향도 받습니다. 또한 전립선암은 가족력과 유전력도 연관됩니다.
전립선암은 고령에서 많이 발생하고, 유전적 소인, 남성호르몬의 영향, 서구 식이 습관(특히 고열량 지방 섭취 증가) 등과 관련이 있습니다. 그 외에 전립선의 감염성 질환, 성관계의 횟수, 사회경제적 상태 등도 영향을 미치는 요인으로 알려져 있습니다.
전립선암은 임상적 증상을 일으키지 않는 잠재성과 조기 암이 많고, 어떤 환자에게서는 공격적으로 빠른 진행을 보이는 데 비해 어떤 환자에게선 여러 해에 걸쳐 진행하는 늦은 성장 속도가 특징입니다. 일본과 한국의 전립선암은 서양 전립선암과는 다르게 Gleason 점수가 높고, 크기에 비해 공격적으로 빠르게 진행하는 암이 많은 인종학적 특성을 가지고 있습니다.
하지만 과거와는 다르게 한국에서도 최근에는 전립선암에 대한 사회적 관심의 증가와 빠른 전립선암 환자 증가 추세, 인구의 고령화, 암 검진의 보편화, 혈중(혈청) 전립선특이항원(PSA, prostate-specific antigen) 측정 검사 도입과 경직장(經直腸) 초음파검사와 향상된 전립선 MRI검사 및 생검 등 진단 기술의 발전에 따라 조기 진단 및 조기 진단되는 경우가 증가하고 있습니다. 그 결과, 적절한 치료가 조기에 시작되어 생존예후가 많이 향상되었습니다.
전립선특이항원(PSA)이란 전립선의 상피세포에서 합성되는 단백분해 효소로, 체내의 다른 조직에서는 거의 나타나지 않기 때문에 전립선암 진단에서 종양표지자(tumor marker)로 이용됩니다. (종양표지자란 종양 세포에 의해 특이하게 만들어져서 암의 진단이나 경과 관찰에 지표가 되는 물질을 말합니다.) 다만, PSA는 암 외에 전립선비대증이나 전립선염, 전립선 경색 등에서도 증가할 수 있으므로 잘 감별해야 합니다. 한편 경직장 초음파검사는 항문을 통해 직장 안에 초음파 탐촉자(探觸子, probe)를 삽입하여 직장 바로 앞쪽에 있는 전립선의 이상을 진단하는 검사법입니다.
나이
나이는 가장 중요한 위험인자입니다. 전립선암은 나이에 비례하여 증가하기 때문입니다. 40세 이하에서는 드물다가 50세 이상에서 급격히 늘어나고, 특히 60세 이후 노인에게 많이 발생합니다. 2011년 우리나라에서 발생한 전립선암 환자의 연령대를 보면 70대가 41.9%로 가장 많고 60대가 36.4%, 80대 이상이 10.9%의 순입니다. 80대 이상의 비율이 낮은 것은 한국 남성의 평균수명이 76세여서 80세 이후는 환자 수가 적기 때문입니다.
인종
전립선암의 발생률과 사망률은 인종에 따라 차이가 크다는 점이 다수의 연구에서 밝혀졌습니다. 발생률은 동양인이 가장 낮고 미국, 캐나다, 스칸디나비아 등에서 가장 높습니다. 또, 미국의 흑인은 전립선암 발생률이 백인보다 30%쯤 높습니다. 일반적으로 흑인은 진단 당시 암의 진행 정도가 비슷했던 백인보다 생존율이 낮아서, 5년 생존율이 흑인은 62%, 백인은 72%입니다.
또 한 가지 흥미로운 것은 미국에 거주하는 일본인의 전립선암 발생률이 미국의 백인들보다는 낮으나 일본 본토인보다는 훨씬 높다는 조사 결과입니다. 이는 생활 환경이 전립선암 발생의 주요 원인 중 하나임을 뜻합니다.
호르몬
전립선은 남성호르몬의 영향을 많이 받는 장기입니다. 체내의 남성호르몬 농도가 전립선암 발생에 어떤 영향을 미치는지는 아직 명확히 밝혀지지 않았으나, 남성호르몬의 대부분을 만들어내는 곳인 고환을 제거하면 전립선암이 생기지 않으며, 전립선암 환자라도 수술이나 약물로 고환을 제거하거나 그 기능을 없애면 암이 퇴화한다고 알려져 있습니다.
미국 국립암연구소(National Cancer Institute)에서 실시한 7년간의 전립선암 예방 연구 결과에 따르면, 남성호르몬 억제제를 복용한 남성에게서 24.8%의 전립선암 유병률(有病率, 어떤 시점에 일정한 지역이나 집단의 인구 중 특정 질환의 환자가 차지하는 비율) 감소 효과가 나타났다고 합니다. 그러나 18개 코호트 연구를 종합한 메타분석에서는 혈중 남성호르몬 농도와 전립선암 발생 간에는 별다른 관련이 없는 것으로 나타났습니다. 코호트 연구(cohort study)는 요인대조 연구라고도 하며, 특정 요인에 노출된 집단과 그렇지 않은 집단을 추적하여 연구 대상 질병의 발생률을 비교함으로써 해당 요인과 질병 발생의 관계를 조사하는 것입니다. 메타분석(meta-analysis)이란 동일하거나 유사한 주제에 대한 누적된 연구 결과들을 종합적으로 검토하는 계량적 연구 방법을 말합니다.
당뇨병
당뇨병이 있으면 전립선암의 발생 위험이 낮다는 연구 결과들이 있습니다. 여러 편의 메타분석 논문에서 비교적 일관성 있게 도출된 결과에 의하면 당뇨병 환자는 그렇지 않은 사람에 비해 전립선암 발생 위험이 10∼20% 낮았습니다. 또한 당뇨병을 앓은 기간이 오래될수록 위험도가 더 감소하는 것으로 나타났습니다.
당뇨병이 전립선암의 발생 위험을 줄이는 기전은 명확하지 않으나, 여러 가지 가설이 제시되었습니다. 그중 하나로, 당뇨병 때문에 체내의 남성호르몬 농도가 낮아져서 전립선암 발생이 감소한다는 해석이 있습니다. 다른 당뇨병 환자는 체내 인슐린 농도가 낮아 전립선암의 위험인자로 작용하는 인슐린형 성장인자 1(insuline-like growth factor 1, IGF-1)의 형성이 제한되기 때문에 전립선암 발생이 적다고 합니다.
가족력 및 유전
전립선암 환자 중 가족력이 있는 사람은 9% 정도로 알려졌습니다. 통계를 보면 형제 중에 전립선암 환자가 있으면 발병 확률이 3배 정도로 높아지고, 일란성 쌍둥이의 경우엔 한쪽이 전립선암이면 다른 쪽도 발병할 확률이 4배 이상입니다. 또, 전립선암의 가족력이 있는 집안은 그렇지 않은 집안에 비해 발병 가능성이 8배 정도 높습니다.
전립선암과 관련된 유전인자는 상염색체(常染色體, 성염색체가 아닌 보통 염색체) 우성 유전을 하며, 비교적 이른 시기의 암 발생을 촉진합니다. 이 유전자의 빈도는 0.003%(10만분의 3)가량인데, 유전에 의한 환자는 전체 전립선암 환자의 9% 정도지만 55세 미만에, 즉 상대적으로 이른 나이에 발생하는 전립선암 중에서는 전립선암의 발생 유전적 요인이 약 45% 정도로 많은 부분을 차지합니다. 관련 유전인자가 성염색체 아닌 상염색체에 존재하는 만큼 부계의 가족력뿐 아니라 모계의 가족력도 중요합니다.
BRCA2, BRCA1, ATM 등의 유전자를 보유한 유전성 전립선암은 흔히 60세가 되기 전에, 특히 55세 이전에 발생합니다. 이는 일반적인 전립선암에 비해 7년 이상 이른 것입니다. 그러므로 국제 권고안에서는 45세부터 전립선암에 대한 조기 검사를 하도록 권고 하도록 하고 있습니다. 또한 일반 전립선암과는 다르게 공격적인 빠른 진행을 보입니다. 이는 서구와 일본의 유전성 전립선암 연구들에서 마찬가지로 나타났으며, 따라서 유전성 전립선암의 양상은 동서양 간에 큰 차이가 없다고 하겠습니다.
비만
비만과 전립선암의 관계를 살펴본 연구에서는 비만이 전립선암 발생 위험을 늘린다는 연구 결과가 있는가 하면 줄인다는 결과도 나왔으며, 양자 간엔 별다른 관계가 없다는 결론도 있었습니다. 하지만 최근의 대규모 역학 연구에서는 비만과 대사성 질환과 전립선암과의 관련성이 있다고 보고 하고 있습니다. 체질량지수가 높다면 높은 병기(病期, 병이 진행된 단계)의 전립선암의 발생과 사망 위험이 증가하는 반면, 낮은 병기의 전립선암 발생은 오히려 줄어드는 것으로 나타났습니다.
한국인을 대상으로 한 연구들에서도 비만할수록 전립선암 발생 위험이 증가하는 양상을 보이는 것으로 나타났습니다. 따라서 적정 체중을 유지하는 것이 전립선암 예방에 좋다 하겠습니다.
음식
식생활이 전립선암에 미치는 영향은 아직 확실히 밝혀지지 않았습니다. 현실적으로 식이(食餌)와 연관된 연구를 하는 것이 쉽지 않습니다. 개인이 장기간 섭취한 음식의 양을 정량화하기가 어렵고 과거의 식생활을 확인하는 조사가 정확할 수 없으므로 원인이 된 음식이나 식습관을 밝히는 일이 매우 힘들 뿐 아니라, 혈중 영양소의 개인차가 매우 다양하고, 식생활 습관도 변하기 때문입니다.
일반적으로는 섬유질이 많고 동물성 지방이 적은 음식을 먹는 것이 전립선암 예방에 도움이 된다고 알려졌습니다. 미국 이주 일본인들에게서 전립선암 발생률이 높아진 것을 동물성 지방 섭취가 늘어난 탓으로 보기도 합니다. 동물성 지방을 과다하게 섭취하면 남성호르몬이 많이 만들어져 전립선암을 유발하기 쉽다는 논리입니다.
기타
전립선암 발생을 부추길 수 있다고 추정되는 다른 요인들도 여럿 있으며, 대표적인 것이 제초제류입니다. 미국의 경우 전립선암에 걸릴 확률이 높다고 밝혀진 유일한 직업이 농업인데, 이는 농부들이 제초제를 비롯한 화학약품에 많이 노출되기 때문이라고 생각됩니다. 고엽제 같은 제초제와 전립선암의 관계는 아주 분명해서, 베트남전 참전 군인 집단의 높은 전립선암 발생이 베트남전 사용된 제초제와 연관성이 있음이 밝혀져, 미국 정부나 한국 정부는 전립선암에 걸린 베트남전 참전 병사들에게 의료 지원을 해주고 있습니다.
전립선암 발생 확률을 높인다고 종종 거론되지만 그렇지 않아 보이는 요인으로는 정관 절제, 흡연, 성관계의 횟수 그리고 전립선 관련 질환(전립선비대증) 등이 있습니다. 운동 여부, 직업의 유무 등도 발암에 영향을 미친다는 확실한 증거가 없습니다.
일반적 증상
개요
일반적으로 전립선암은 다른 대부분의 암에 비해 증식하는 속도가 느립니다. 그러므로 초기에는 별다른 증상이 없으나, 암이 어느 정도 진행되면 주변 장기의 침범관련 증상, 대표적으로 각종 배뇨 증상과 전이 관련 전신 증상이 생깁니다.
요도를 둘러싸듯이 있는 전립선 조직에 암세포가 생겨서 증식하면 요도를 압박하여 소변이 잘 나오지 않고, 줄기도 가늘어지며, 다 보고 난 후에도 소변이 남아 있는 듯한 잔뇨감이 들게 됩니다. 소변이 급박하게 마렵거나 심지어는 참지 못하고 지리는 등의 증상이 나타나며, 낮이나 밤이나 소변을 자주 보게 되고, 어떤 경우에는 소변이 전혀 나오지 않는 급성 요폐(尿閉)를 일으키기도 합니다. 간혹 정액에 피가 섞여 나오거나, 육안으로 확인되는 혈뇨가 나오기도 합니다.
전립선암이 더욱 진행되면 요관 폐쇄에 의한 수신증(水腎症, ‘물콩팥증’이라고도 하며 요로나 방광으로 나가지 못한 오줌이 신장에 들어차 신우와 신배가 늘어나 있는 상태)과 신부전(腎不全) 증상, 골 전이에 의한 뼈의 통증, 척추 전이로 인한 요통이나 좌골신경통 등이 나타나게 됩니다.
국소적 원인에 의한 증상
방광 배출로 폐색에 따르는 증상
전립선의 종양이 커지면 배뇨통, 빈뇨(頻尿, 잦은 배뇨), 느린 배뇨, 완전 요폐(요도가 막혀서 오줌이 나오지 않는 것), 급박뇨(소변을 보고 싶은 마음이 긴박하게 들고, 소변을 보러 가다가 누어버리기도 하는 증상), 간헐뇨(소변 줄기가 중간에 끊기곤 하는 것), 잔뇨감(다 누고 나서도 방광 속에 소변이 남아 있는 느낌이 드는 것), 야간 빈뇨, 힘을 주어야 배뇨가 가능한 증상 등이 나타날 수 있습니다. 이러한 증상들은 물리적이거나 기능적인 방광경부(방광에서 요도로 넘어가는 부분) 폐쇄에 따른 것입니다. 대부분의 전립선암은 전립선의 다섯 구역 중 요도 주위의 이행대(移行帶)가 아닌 말초대(末梢帶)에 생기므로 병변이 작은 초기 암에서는 방광경부가 폐쇄될 가능성이 매우 낮습니다. 참고로, 15∼20%의 환자는 암이 이행대에 생기는데, 이러한 암은 전립선비대증에 대한 경요도(經尿道) 절제술 시행 후 조직검사를 하다가 우연히 조기에 발견되곤 합니다.
혈뇨와 혈정액증
혈뇨 즉 피가 섞여 나오는 오줌은 전립선암에 비특이적이며 흔하지 않아서 환자의 15% 미만에서 생깁니다. 암이 전립선 요도나 방광의 삼각부(trigon)라는 곳으로 국소 침윤을 했을 경우에, 혹은 암에 동반된 전립선비대증에 의하여 혈뇨가 나올 수 있습니다. 정액에 피가 섞여 나오는 혈정액증은 전립선암에서 흔한 것은 아니지만 노년층에서 이런 증상이 보인다면 암일 가능성을 생각해야 합니다.
국소 침윤이 심화되었을 때의 증상
전립선암 국소 침윤의 후반기에 나타나고 광범위한 전이의 가능성을 시사하는 것으로 암의 직장(直腸) 침범과 음경지속발기증(priapism, 성적 자극이 없는데도 음경이 통증을 수반하며 지속적으로 발기해 있는 증상)이 있습니다. 직장 침범 시에 흔한 증상은 변비, 복통, 직장 출혈, 간헐적인 설사 등입니다. 또한 요관 원위부(遠位部, 신장에서 먼 부위, 즉 아래쪽)의 폐쇄가 일어나기도 하며, 이로 인해 신기능 부전이나 요독증과 관련된 증상이 나타날 수 있고, 무뇨(無尿), 핍뇨(乏尿, ‘소변 감소증’이라고도 하며 오줌의 양이 뚜렷이 줄어드는 것), 부종(浮腫, 몸 전체나 일부가 부어오르는 것), 액체 저류(瀦留, 고이는 현상), 그리고 고칼륨혈증, 저나트륨혈증, 저칼슘혈증, 고뇨산혈증 등에 따른 증상이 생기기도 합니다.
전이에 의한 증상
전립선암이 생긴 것을 모르고 있다가 전이로 인한 증상을 통해 암을 발견하게 되는 경우가 적지 않습니다. 일부 환자는 조기에 원격전이가 나타나기도 하고, 어떤 경우엔 원격전이 소견 없이 전립선 주변 부위를 광범위하게 침범하기도 합니다. 골반 림프절과 골반뼈, 척추뼈 등이 흔히 전이되는 곳입니다.뼈의 통증
전립선암 전이 환자에게 가장 흔한 증상 중 하나가 허리나 엉덩이 부위의 간헐적이고 매우 심한 통증입니다. 골 스캔(bone scan, 뼈 스캔) 검사들을 보면 전립선암은 척추뼈, 늑골(갈비뼈), 골반뼈, 대퇴골(넙다리뼈), 어깨뼈 등에 잘 전이됩니다. 이는 나아가 뼈관련 증상을 유발하며 암이 진행되면 체중을 지탱하는 뼈의 병리적 골절이 발생됩니다. 대표적으로 대퇴골, 상완골(위팔뼈), 척추뼈 등에 병리학적 골절이 생깁니다. 병리적 골절이란 외상이 아니라 뼈의 병리적 변화로 인해 뼈가 약해져서 골절이 되는 것을 말합니다.
림프절 전이로 인한 부종
전립선암은 주변 림프절로 잘 전이되지만, 전이 암이 정맥 혈관이나 림프액 흐름을 압박할 정도로 커지는 경우는 드뭅니다. 따라서 하지(下肢, 다리) 말초 부위나 음낭의 부종은 암의 진행을 시사합니다.
신경 장애
진행된 전립선암 환자들에게는 척수 압박으로 인한 하지 운동신경 장애 등 신경 증상이 흔히 나타나며, 환자의 20%까지 그런 증상을 보입니다. 일반적으로 초기 암은 신경 증상이 없습니다. 척추 경막외(硬膜外) 전이에 의해 척추관이 좁아져서 척수를 압박하는 급성 척추 압박은 즉각적인 치료를 요하는 응급 상황입니다. 경막은 뇌와 척수를 둘러싼 세 겹의 뇌막 중 가장 바깥에 있는 것을 말합니다.
기타 증상
전립선암이 뼈와 림프절 이외의 장기를 침범하는 경우는 드뭅니다. 혹 침범이 일어났다면 광범위한 전이의 일환인 경우가 많습니다. 내장 기관으로의 전이는 종종 비특이적인 증상을 보이는데, 폐 전이에서는 기침과 호흡 곤란이, 간 전이에서는 황달이 나타날 수 있습니다.
진단방법
개요
전립선암의 병기(病期, stage)는 직장수지검사, 혈중 전립선특이항원(PSA)검사, 경(經)직장 초음파검사, 전립선 생검, 종양의 조직학적 분화도 확인, 방광내시경, 각종 영상진단법, 골반강(骨盤腔) 내 림프절(이하 ‘골반 림프절’) 절제술 등을 시행한 후 모든 소견을 종합하여 판정합니다. 영상진단법으로는 골(뼈) 전이 여부를 알아보는 골 스캔, PSMA/Ga-PET CT, 주위 조직 침습 여부와 골반 림프절로의 전이 여부를 알기 위한 복부 전산화단층촬영(CT)이나 자기공명영상검사(MRI) 같은 것이 이용됩니다.
전립선암 초기에는 암이 아직 주변으로 퍼지지 않았기에 치료가 잘 되지만 진행이 되고 나면 다른 암들과 마찬가지로 완치가 어려우므로 완치를 위해서는 조기 진단이 매우 중요합니다. 전립선암 증상 중 배뇨의 문제들은 전립선비대증에서도 다양하게 나타나는 만큼 혈중 전립선특이항원검사, 직장수지검사, 전립선 MRI, 경직장 초음파검사와 생검 등이 조기 진단에 도움을 줍니다.
그러나 완치율이 높은 국소암 단계에서 진단되는 경우는 2/3정도에 불과하고 나머지 1/3은 진행된 진행/전이 전립선암으로 발견됩니다. 아직 국가 조기 암검진에는 전립선암 조기 검진 항목으로는 들어가 있지 못하고, 개인적으로 시행하는 건강검진 항목에는 최근 들어 간단한 전립선특이항원검사를 포함시키는 경우가 많아져서 조기 발견이 꾸준히 늘고 있습니다.
진단 검사의 종류
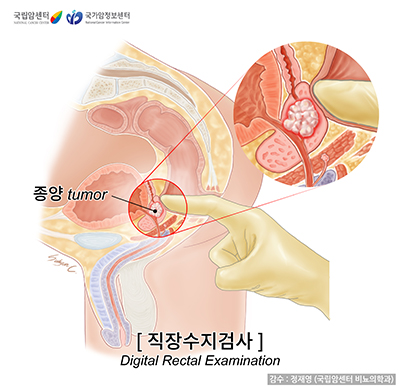
직장수지검사
전립선암의 진단은 의사가 직접 실시하는 직장수지검사로 시작됩니다. 항문을 통해 직장(곧창자) 속으로 수지(手指) 즉 손가락을 넣어 전립선 후면을 만져보며 전립선의 크기와 딱딱한 정도, 주변 조직과의 관계를 짚어내는 검사로, 간단하고 안전합니다. 전립선암은 상당히 진행이 되기 전에는 뚜렷한 증상이 없습니다. 따라서 증상 유무와 상관없이 일률적으로 직장수지검사를 실시해서 이 암에 특징적인 국소 변화가 있는지를 알아보는 것인데, 혈중 전립선특이항원(PSA)검사가 광범위하게 이용되기 전에는 별다른 증상이 없는 완치 가능한 단계의 전립선암은 대개 이 검사의 이상 소견을 통해 일차 진단이 되곤 했습니다. PSA검사가 일반화된 요즈음에도 전립선 내에 국한된 암을 발견하는 수단으로 매우 유용해서, 50세 이후의 남성은 매년 직장수지검사를 받도록 권고하고 있습니다.
수지검사에서 딱딱한 결절(結節) 즉 멍울이 만져지면 전립선암을 의심해볼 수 있습니다. 물론 그런 결절이 모두 암은 아닙니다. 전립선 결핵, 육아종성(肉芽腫性) 전립선염, 섬유화된 전립선염, 전립선 결석 등에서도 결절이 만져질 수 있으므로 이들과의 감별이 필요하며, 암이 의심되는 경우에는 조직검사 즉 생검(生檢)이 불가피합니다. 결절 외에 경화(硬化. 딱딱해진 것), 표면의 이상, 정상적 경계의 소실, 비대칭성 등도 전립선암과 관련이 있는 소견입니다. 암이 강력하게 의심되는 결절이나 경화의 50% 정도에서 악성 종양 즉 암이 발견되는 것으로 보고되었습니다.
유의할 점은, 직장수지검사가 매우 유용하기는 해도 병변이 상당히 진행되기 전에는 결절이 촉진되지 않는 경우가 많기 때문에 전립선암 조기 진단을 이 검사에만 의존할 수는 없다는 것입니다.
참고로 덧붙이면, 위에서 언급한 육아종(肉芽腫)이란 육아조직을 형성하는 염증성 종양이며, 육아조직이란 모세혈관과 섬유 모세포 따위로 이루어진 증식력이 강한 어린 결합조직을 말합니다. 우리 몸의 상처가 아물어가는 과정에서 볼 수 있는 유연하고 과립상(顆粒狀)인 선홍색의 조직이 바로 이것입니다.
혈중 전립선특이항원(PSA)검사
전립선특이항원(prostate-specific antigen, PSA)은 전립선의 상피세포에서 생성되고 정액의 액화(液化)에 관여하는 단백질 분해효소입니다. PSA는 전립선암의 진단에 매우 중요한 종양표지자(tumor marker)여서, 전립선암이 있으면 이것의 수치가 올라갑니다.
그러나 혈중 PSA 수치는 암이 없어도 나이가 들수록 증가하고, 같은 나이라도 인종에 따라 다릅니다. 전립선암의 유병률(有病率)이 낮은 동양인의 경우, 전립선 크기가 작고 PSA의 정상 수치가 서양인보다 낮기 때문에 서구의 기준을 그대로 적용하면 암을 놓칠 위험이 있습니다. 또한 PSA는 전립선비대증, 전립선염 같은 다른 질환에서도 수치가 상승하며, 경요도(經尿道) 전립선 수술, 전립선 생검 등의 전립선 조작 후와 사정 후에도 증가합니다. 그래서 전립선특이항원검사의 임상적 유용성을 높이기 위해 PSA의 연령별 참고치와 그 밀도, 속도 등을 추가적 판단 요소로 도입했습니다.
혈중에서 PSA는 다른 단백질과 결합된 형태로 존재하기도 하고 유리형(遊離型) 즉 따로 떨어진 형태로 있기도 하는데, 전립선암에서는 결합된 형태를 더 많이 만들고 유리형의 비율이 감소하는 경향이 있으므로 유리형 PSA의 비율을 측정하는 것도 진단에 도움이 됩니다.
PSA 수치가 4~10ng/ml인 전립선암 환자의 3분의 2는 전립선에 국한된 암이고, 10ng/ml 이상인 환자는 50% 이상이 진행된 암이며, 20ng/ml 이상인 환자의 20%에서 골반 림프절 전이가 있다고 합니다. 1ng 즉 1 나노그램은 10억분의 1 그램입니다.
전립선 절제술을 받으면 PSA 수치가 측정 가능치 이하로 떨어집니다. 만약 그 이상으로 유지된다면 잔류 종양이 있다고 봐야 하며, 암이 불원간 재발할 가능성이 큽니다. 방사선치료를 받아도 PSA가 감소하지만, 조기 병변인 경우에도 수치가 측정 가능치 이하로 완전히 떨어지는 데에는 6~12개월이 걸립니다. 한편 호르몬요법 후의 PSA 수치 하락은 암세포가 감소했기 때문만이 아니라 남성호르몬의 제거로 인한 유전자 발현의 감소 때문이기도 합니다. 혈중 전립선특이항원이 감소하는 정도와 속도는 치료 결과와 밀접한 관련이 있습니다.
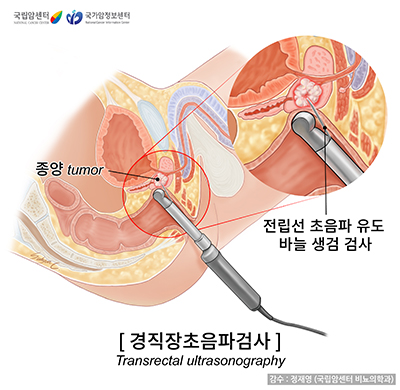
경직장 초음파검사와 조직 생검
경직장(經直腸) 즉 직장을 통해서 하는 초음파검사(transrectal ultrasound, TRUS)는 직장수지검사로는 확인되지 않는 병변을 발견하고 그와 관련하여 전립선의 용적을 계산하기 위해 시행하며, 정낭(精囊, 정관의 끝에 위치하며 정액을 생산하는 주머니)이나 전립선 피막(皮膜)의 침범 여부를 파악해 국소적 병기를 결정하는 데도 이용됩니다.
하지만 경직장 초음파검사에서 암이 의심되는 경우 중 실제 암으로 확인되는 것의 비율이 낮다는 단점이 있어서, 이를 보완하기 위해 최근에는 혈류 증가를 관찰할 수 있는 색도플러(color Doppler) 초음파검사를 보조적으로 이용하고 있습니다.
전립선암을 진단하기 위한 조직검사는 주로 경직장 초음파의 유도 아래 침생검(針生檢, needle biopsy)을 합니다. 항문을 통해 직장에 초음파 기구를 넣어 전립선을 관찰하면서 전립선을 여러 구획으로 나누어서 각각의 구획에서 조직을 채취해낸 후 병리 검사를 하는 방법입니다. 혈중 전립선특이항원(PSA)검사에서 전립선암이 의심되었으나 경직장 초음파검사에서는 특별한 병변이 보이지 않았을 경우엔 전립선 6~12곳의 조직 생검을 하게 됩니다.
특히 전립선암 환자의 일부는 PSA 검사치가 정상 소견을 보이므로, PSA 수치가 낮더라도 직장수지검사에서 딱딱한 결절이 만져지는 등 이상 소견이 있으면 조직 생검을 해서 암 여부를 확진해야 합니다. 전립선암의 일부는 일차 생검에서 확인이 안 되기도 하는데, 그럼에도 의심스러운 증상이 보이거나 PSA가 계속 빠르게 증가하는 등 암이 강하게 의심되면 조직검사를 다시 하게 됩니다.
전립선 조직검사는 비교적 안전한 시술이지만, 일시적인 통증과 혈뇨 등의 부작용이 올 수 있습니다. 약간의 혈뇨는 7일쯤 지속되기도 합니다. 이 밖에 정액에 피가 섞여 나오거나 직장에서 출혈이 보이기도 하는데, 임상적으로 별다른 문제가 되지는 않습니다. 가장 심각한 합병증은 패혈증(敗血症)으로, 약 2%의 환자에게서 발생합니다. 패혈증이란 곪아서 고름이 생긴 상처나 종기 따위에서 병원균 등 미생물이나 그것이 만들어낸 독소가 혈관으로 들어가 순환하면서 심한 중독 증상 또는 급성 염증을 일으키는 것입니다. 패혈증이 생기면 입원 치료를 해야 합니다. 때로 전립선이 부어서 소변 보기가 힘들거나, 아주 드물게 소변을 아예 못 보는 경우도 있습니다. 이럴 때는 소변을 볼 수 있도록 도뇨관(導尿管)을 설치하는 등의 조치가 필요합니다.
골 스캔
영상검사를 통한 진단 방법의 하나로 골(骨) 스캔(bone scan, 뼈 스캔)이 있습니다. 전립선암은 말기에 뼈로 전이되는 수가 많은데, 이를 확인하려 할 때 방사성 동위원소를 이용한 골 스캔을 시행합니다. 방사선학적으로 활성화된 소량의 물질을 정맥 내로 주입하고 모든 뼈에 그 물질이 침착될 때까지 한 시간 이상을 기다린 뒤 핵의학 카메라로 약 30분간 환자의 뼈를 검사하는 방법입니다.
골 스캔은 전립선암의 골 전이 확인에 가장 좋은 검사법이나, 모든 환자에게 시행하지는 않습니다. 혈중 전립선특이항원(PSA) 수치가 1ml당 10ng(나노그램)미만이면서 뼈에 동통(疼痛), 즉 쑤시고 아픈 증상이 없는 환자들은 전이가 발견될 가능성이 낮기 때문에 골 스캔을 시행하지 않아도 됩니다.
복부 전산화단층촬영(CT) 또는 자기공명영상(MRI)
암 덩이까지 포함한 전립선의 크기를 측정하고 암이 주위 조직에 얼마나 침습했는지, 골반 림프절로 전이가 되었는지 등을 확인하려 할 때 전산화단층촬영(computed tomography, CT)이나 자기공명영상(magnetic resonance imaging, MRI) 등의 영상검사를 합니다. 두 검사 모두 민감도(sensitivity)가 낮기 때문에 항상 시행하지는 않고, 주로 다음과 같은 경우에 이용합니다. 즉 골 스캔 결과는 정상이나 직장수지검사에서 국소적으로 진행된 암이 의심될 때, 혈중 전립선특이항원의 수치가 높고 침생검에서 암 조직의 분화도가 나쁘게 나타났을 때(글리슨 점수 4 또는 5) 등 전이 가능성이 높은 경우에 골반 림프절 전이 여부를 판단하기 위해 시행합니다.
전립선암의 진단에서 MRI의 양성 예측도는 경직장 초음파검사보다는 높지만 선별 검사로 사용할 수 있을 정도는 아닙니다. 게다가 비용도 많이 듭니다. 이 암에서 MRI의 가장 중요한 역할은 국소적 병기의 결정을 돕는 데 있습니다.
직장 내 자기공명영상
직장 내 자기공명영상(endorectal MRI)이란 직장 안에 표면 코일을 삽입하고 자기공명영상(MRI)을 시행하는 방법입니다. 이렇게 하면 공간의 해상도가 높아져서 전립선암 진단에 많은 도움을 주지만, 병기 결정에서의 정확도는 52~91%로 다양합니다.
자기 공명 영상은 전립선 조직검사 대신으로 전립선암 진단에도 사용할 수 있습니다. 다만 보험 적용이 전립선암 진단 목적으로는 안되어 비용이 많이 든다는 단점이 있습니다. 하지만 PSA(전립선 특이 항원 검사)수치가 높아 추적관찰 중인 환자나 조직검사의 적응증에 있는 환자에서 전립선 조직검사의 부작용 및 검사를 할 수 없는 경우에는 자기 공명 영상을 이용한 암 감별진단법이 도움이 됩니다.
PET/CT와 PET/MRI
PET CT는 핵의학 영상 검사법으로 전립선암에서 전이 여부를 판단하는 최근 검사법으로 아직까지 국내에는 연구용 목적으로만 사용되는 영상검사법입니다. 하지만 향후 골스캔과 함께전립선암의 전이 여부를 진단하는 영상 검사법으로 자리 매김할 것으로 보입니다. PET/CT로는 68Ga-/18F-labeled PSMA 물질을 이용한 positron emission tomography이 많이 사용될 것으로 보입니다.
골반 림프절 절제 후 조직검사
전립선암의 임상 병기가 높고 전립선특이항원(PSA) 수치가 클수록, 또는 암세포의 분화도가 나쁠수록 림프절로 전이됐을 가능성이 큽니다. 임상적으로 국소 전립선암의 약 5~12%에서 골반 림프절 전이가 발견되는 만큼, 전이 여부를 미리 아는 것은 치료 방침을 결정하는 데 매우 중요합니다. 전이 여부를 가장 정확히 아는 방법은 수술로 골반 림프절을 떼내어 조직검사를 하는 것입니다. 이는 흔히 근치적 전립선 적출술(절제술) 직전에 시행하며, 개복하지 않고 복강경을 이용하기도 합니다. 그러나 임상적 병기가 높지 않고 혈중 PSA 수치가 1ml당 10ng(나노그램) 미만, 글리슨 점수가 7 미만인 경우에는 골반 림프절 전이 가능성이 매우 낮으므로 병기 결정을 위한 림프절 절제술을 생략할 수 있습니다.
분자생물학적 방법
말초 혈액에 존재하는 전립선암 세포가 들어 있는지를 정밀하게 확인하여 병기를 보다 확실히 판단해 주는 것이 분자생물학적인 방법입니다. 혈중 전립선특이항원(PSA)이나 전립선 줄기세포항원(prostate stem cell antigen, PSCA)의 전령 RNA(messenger RNA)라는 것을 ‘역전사효소-중합효소 다중연쇄반응’이라는 방법으로 증폭시킨 후 전립선암 세포를 극미량까지도 찾아내는 것입니다.
말초혈액에서 암세포가 발견된다는 것은 암이 전립선 밖으로 퍼져나갔음을 뜻합니다. 이를 조기에 발견하면 치료법의 선택, 수술 후 재발 예측 등에 두루 도움을 줄 터이나 분자생물학적 방법은 아직 연구 단계에 있습니다. 나아가 조직내 ARV7같은 전립선암 세포의 특이 유전자 유무에 따른 예후를 판단할 수 있는 분자 생물학적인 방법도 많이 사용되고 있습니다.
치료방법
개요
전립선암의 치료 방법을 결정할 때는 병기와 종양의 분화도, 환자의 나이와 건강 상태, 예측된 생존 기간 등 관련 요소들을 두루 고려합니다. 병기는 암이 얼마나 진행되고 퍼져 있는지를, 분화도는 암 조직이 정상 조직과 얼마나 다르며 어느 정도 악성인지(얼마나 공격적인 진행을 보이는지)를 나타냅니다.
전립선암의 치료 방법으로는 적극적 관찰요법, 근치적 수술, 방사선치료, 호르몬치료(1차, 2차), 항암화학요법(1차, 2차, 3차), 면역치료, 국소 치료 (냉동, 전기, 고주파열) 등이 있습니다. 경우에 따라 한 가지 이상을 병행하는 것이 효과적이어서, 최근에는 방사선치료와 호르몬치료 그리고 항암치료와 호르몬치료의 병합요법도 널리 쓰입니다. 치료법을 선택할 때는 그것이 환자의 삶의 질에 어떤 영향을 줄지를 부작용 등을 충분히 고려해야 합니다.
국소 전립선암의 치료
치료의 선택
국소 전립선암, 즉 원발 부위인 전립선에 국한된 암의 치료 목표는 급성이나 만성의 부작용들을 최소화하면서 완치시키거나 암의 진행을 최대한 늦추거나 암을 추적관찰하다가 적절한 시기에 치료를 시작하는 것입니다. 국소 전립선암의 치료 방식은 최근 들어 다양한 연구가 진행되는 분야입니다. 각 환자에게 적절한 치료법을 선택하는 데는 환자의 병기(cT-stage 즉 T 병기)와 치료 전의 혈중 전립선특이항원(iPSA) 수치, 그리고 글리슨 점수(GS)를 모두 고려하여 위험군을 분류해 놓은 미국 종합암네트워크(NCCN)의 기준이 유용합니다.
병기(cT-stage)와 치료 전 전립선특이항원 수치(iPSA, ng/ml) 및 글리슨 점수(GS)에 따른 위험군 분류
| 기 준 | 저 위험군 | 중등도 위험군 | 고 위험군 |
|---|---|---|---|
| NCCN 기준 | T1-T2a; iPSA < 10; GS < 6 | T2b-T2c or iPSA 10 to 20 or GS 7 | T3a or higher or iPSA > 20 or GS > 8 |
NCCN=National Comprehensive Cancer Network, 미국의 종합암네트워크
이러한 위험군 분류 외에 치료법의 선택에 영향을 줄 수 있는 요인으로는 환자의 연령, 기저질환, 건강 상태, 기대 여명, 예상되는 부작용의 빈도와 심각도, 환자의 선호와 의사의 선호(편향) 등이 있습니다. 치료에 따라 예상되는 합병증도 사뭇 달라서, 예컨대 수술 후에는 요로와 성기능의 지장이 흔한 반면 방사선치료 후에는 직장 후유증이 더 빈번합니다. 그러므로 환자는 비뇨기과 및 방사선종양학과의 전문의와 충분히 상담한 뒤에 어떤 치료를 받을지 결정해야 합니다. 예를 들어, 환자가 저위험군에 속한다면 대기 관찰치료를 통해 추적관찰을 하면서 적절한 시기에 적극적인 치료를 하거나, 고령으로 생존기간이 5년이하거나 기저질환이 많은 환자의 경우는 능동적 치료 없이 관찰 요법이나 호르몬치료 정도만 할 수도 있습니다.
관찰요법, 즉 적극적인 치료를 하지 않고 병의 추이를 면밀히 관찰하는 것(대기관찰요법이라고도 합니다)은 나이가 많고 종양의 분화도로 보아 저위험군에 속하는 환자에게는 적절할 수도 있으나, 기대 여명이 10년 이상이거나 중등도 이상의 위험군에 대해서는 보다 적극적인 치료가 바람직합니다. 이 경우 근치적 전립선 절제술 또는 방사선치료를 적용할 수 있는데, 완치 확률에는 차이가 없습니다. 수술과 방사선치료의 병용은 합병증이 증가할 우려 때문에 권장하지 않습니다. 하지만 수술 후 절제연(절제면, 즉 절제 부분의 가장자리)에서 암세포의 침습이 확인되거나 혈중 전립선특이항원(PSA)이 검출되면 방사선치료가 필요할 수도 있습니다.
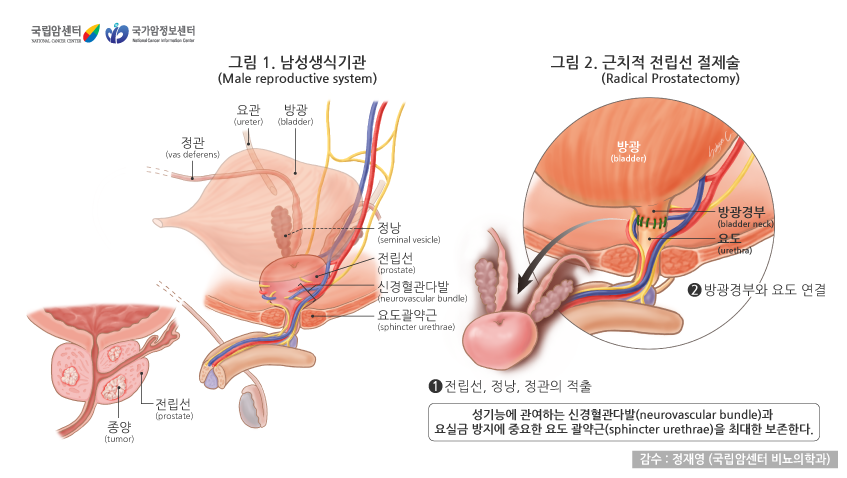
근치적 수술
전립선 전체와 정낭, 정관 등 주변 조직, 그리고 골반 림프절까지 함께 제거하는 것을 근치적 전립선 절제술 혹은 적출술(radical prostatectomy)이라고 하며, 전립선에 국한된 암을 치료하는 대표적인 방법입니다. 최근에는 전립선 부위의 해부학적 구조와 기능에 대한 지식이 깊어지고, 발기에 관여하는 신경혈관다발(neurovascular bundle)과 요실금(尿失禁, 자신의 의지와 무관하게 오줌이 나오는 증상) 방지에 중요한 요도 괄약근을 최대한 보존하는 수술 기법이 발전한 결과 요실금과 발기부전 같은 합병증이 크게 줄었습니다. 또한 로봇을 이용한 로봇 수술은 보다 정밀한 절제술이 기능하여 수술관련 합병증이 더욱 감소하고 빠른 회복기간을 보입니다. 국소 전립선암에서 근치적 전립선 절제술은 완치를 기대할 수 있는 효과적 치료법입니다. 그러나 암이 전립선에 국한되지 않은 경우에는 추가 치료(호르몬, 방사선치료)가 필요할 수 있습니다.
근치적 전립선 절제술의 적응증
적응증이란 어떤 약제나 요법에 의해 치료 효과가 기대되는 병이나 증상을 가리키는 말입니다. 근치적 전립선 절제술의 적응증은 다음과 같습니다.
- 병리조직학적으로 진단된 전립선암
- 임상적 국소암(T1~T2 병기)
- 10년이상의 생존이 예상되는 경우
- 수술에 다른 금기사항이 없는 경우
근년 들어 혈중 전립선특이항원(PSA)검사와 전립선 조직검사, 영상진단법 등이 발달하여 전립선암의 조기 진단이 가능해진 데다 해부학적 지식과 수술 기법의 진전에 따라 합병증도 많이 줄어든 결과, 근치적 전립선 절제술을 국소 전립선암의 적극적인 치료법으로 우선적으로 선택하게 되었습니다. 적절한 조건의 환자라면 완치를 기대할 수 있으나, 다음의 몇 가지를 종합적으로 고려한 뒤 선택해야 합니다.
첫째, 근치적 전립선 절제술에 의한 사망, 합병증 및 다른 부작용의 가능성. 둘째, 수술에 따른 성기능 장애와 요실금(오줌이 뜻하지 않게 저절로 나오는 증상)의 위험성. 셋째, 수술의 심리사회적인(psychosocial) 결과. 넷째, 치료 전에 병기를 결정하기 위해 시행하는 검사들의 정도와 위험성. 다섯째, 치료에 따른 경제적 부담.
최근 수술 시 직장이 손상되는 경우는 대략 1% 미만이며 심근경색, 심부정맥 혈전증, 폐색전증 등이 1% 내외, 방광-요도 문합부(吻合部) 협착은 4% 내외인 등 합병증의 발생이 현저히 감소했으며, 출혈로 인해 수혈을 하게 되는 비율도 많이 낮아졌습니다(문합부란 수술 후 연결한 부위를 말합니다).
근치적 전립선 절제술은 하복부를 절개하고 치골 뒤쪽으로 병소에 접근하는 근치적 치골후 전립선 절제술(radical retropubic prostatectomy, RRP)과 회음부 절개를 통한 근치적 회음부 전립선 절제술(radical perineal prostatectomy, RPP)로 대별되며, 최근에는 복강경이나 수술 로봇을 이용한 근치적 절제술도 시도되고 있습니다.
이중 치골후 절제술은 전립선과 동시에 골반 내 림프절도 적출할 수 있다는 것이 장점입니다. 그러나 음경의 배부정맥(背部靜脈)을 박리하여 결찰(結紮, 혈관이나 조직의 어느 부분을 잇고 혈행을 멎게 하는 것)해야 하므로 출혈이 심해서 수혈이 필요한 경우가 많습니다. 회음부를 통한 절제술은 음경 배부정맥을 결찰할 필요 없이 전립선을 적출할 수 있어서 출혈이 거의 없으며 적출 후에 방광경부와 요도를 문합할 때도 시야가 좋은 것이 장점이나, 직장을 손상할 위험이 있고 골반 림프절을 제거하려면 새로 복부를 절개해야 한다는 단점이 있습니다. 이때 개복을 하지 않고 작은 절개창만 내고 복강경을 넣으면 림프절 전이 여부를 확인하면서 바로 절개까지 할 수 있으므로 근치적 회음부 전립선 절제술과 함께 복강경을 이용한 골반 림프절절제술이 많이 이용됩니다. 회음부 절제술 때 림프절 전이의 가능성이 매우 낮다면 아예 림프절 절제를 하지 않는 수도 있습니다.
임상적 국소 전립선암에 대한 근치적 전립선 절제술의 치료 성적은 아주 좋습니다. 적절한 조건의 환자에게 시행했을 경우, 전립선암이 없는 일반인과 같은 수명을 기대할 정도입니다. 다만, 수술 후 종양 조직을 병리조직학적으로 분석하여 확정하는 병리학적 병기(pathologic stage)와 달리 수술 전에 각종 검사를 통해 측정하는 임상적 병기(clinical stage)는 정확지가 않아서, 전립선에 국한된 것으로 생각했던 종양 가운데 많게는 50%까지 피막 외 침윤이 있으며, 중등도 혹은 고위험군에서는 암의 재발도 흔한 것으로 알려졌습니다.
암이 전립선 내에만 국한된 경우, 수술 후 10년간 재발 없이 생존할 확률은 70~85%입니다. 그러나 근치적 절제술을 받은 환자의 10~40%는 5년 내에 혈중 전립선특이항원(PSA) 수치가 측정 가능치 이상으로 상승할 수 있는데, 이것은 치료가 실패했음을 의미하며 결국 7~10년 내에 임상적으로 재발하게 됩니다.
수술 전 혈중 PSA 수치가 높고 암의 분화도가 나쁘며, 수술 후 확인한 병리학적 병기가 높을수록(특히 암이 전립선 피막 또는 정낭을 침범했거나 절개면 양성의 소견을 보였을 경우) 재발의 위험이 큽니다. 수술 후 PSA 수치가 올라가 재발이 의심될 때는 재발 부위의 정확한 파악이 매우 중요합니다. 특히 수술 부위의 국소적인 재발인지 아니면 다른 장기로의 원격전이인지를 아는 것이 치료 방침을 결정하는 데 필수적입니다. 이러한 이유에서 수술 후 추적관찰에서 첫 1년간은 3개월마다, 2년째부터 3년까지는 6개월마다, 그 후에는 매년 한 차례씩 PSA 수치를 측정하는 것이 권장됩니다.
요약하면, 전립선 절제술의 장점은 국소 전립선암의 경우 완치를 기대할 수 있다는 것입니다. 단점은 합병증으로 출혈, 직장 손상, 요관 손상, 신정맥 혈전증, 폐색전증, 골반 림프류(瘤), 수술 부위 감염, 요로 감염 등이 발생할 수 있으며, 후기 합병증으로 요실금, 발기부전 요도 협착 등이 올 수 있다는 점입니다.
최근에는 전이 전립선암에서도 수술적 치료의 효과가 나타나 수술을 합니다. 하지만 이때는 수술만으로는 치료의 한계가 있어 2차 호르몬 치료와 항암치료, 방사선치료를 병합하여 치료를 하여야 합니다. 전이 전립선암의 수술치료의 목적은 암전이로 인한 증상발생기간을 늦추고(무증상 진행기간), 전이 진행을 늦추며, 암의 종양 부피를 줄여 치료효과를 극대화 하는 것입니다.
방사선치료
방사선치료의 종류
① 외부 방사선치료
외부 방사선치료(external beam radiotherapy)란 말 그대로 몸 외부에서 각종 장비를 이용하여 방사선을 조사하는 것입니다. 요즘 많이 쓰이는 진전된 치료 방식들은 다음과 같습니다.
3차원 입체조형 방사선치
방사선치료를 할 때는 정상 조직이 방사선을 과도하게 쐬지 않도록 방사선치료기(주로 선형가속기)의 회전축을 종양에 위치시키고 여러 방향에서 조사(照射)하게 됩니다. 이렇게 하면 종양 조직은 모든 방향에서 방사선을 받지만 정상 조직은 일부 방향에서만 노출되므로 부작용을 줄일 수 있습니다. 3차원 입체조형 방사선치료(3D conformal radiation therapy[radiotherapy], 3D-CRT)는 이에서 더 나아가, CT 영상을 기반으로 종양과 그 주위 조직을 3차원 입체 영상으로 재구성한 후 다엽 콜리메이터(multi-leaf collimator, 多葉視準器)라는 부가 장치를 이용하여 개구부(開口部, 방사선이 나오는 곳)의 모양을 방향별 종양 형태에 맞춰 변화시키며 방사선을 쏘는 방법입니다. 이렇게 하면 통상적 방사선치료보다 정상 조직을 더 잘 보호하고 종양에는 더 많은 방사선을 조사할 수 있습니다. 현재 거의 모든 종양에 사용되는 기법입니다.
세기조절 방사선치료
3차원 입체조형 방사선치료는 종양의 형태에 따라 개구부의 형태만 맞추지만, 세기조절 방사선치료(intensity-modulated radiation therapy, IMRT)는 그에 더해 각 부위에 들어갈 선량까지 조절합니다. 이 방법의 장점은 방사선 통과 경로에 종양이 있으면 선량(線量)을 늘리고 정상 장기가 있으면 선량을 감소시켜 부작용을 줄이면서 치료 효과를 높이는 데 있습니다. 종양이 주요 장기에 근접해 있는 경우에 특히 유용합니다. 전립선암에서는 방광 및 직장의 방사선 노출을 줄여 합병증을 줄이는 동시에 전립선 부위로 가는 선량을 늘림으로써 국소 제어율을 향상시킬 수 있습니다. 일반적으로 3차원 입체조형 방사선치료보다 우수한 치료 효과를 보입니다.
영상유도 방사선치료
전립선암의 방사선치료에서는 특별한 경우를 제외하고 주 5회씩 7~8주에 걸쳐 70~80Gy(gray, 물체가 흡수한 방사선의 양을 나타내는 단위로, 1 그레이는 1 킬로그램의 물질에 1 줄[J=joule]의 방사선 에너지가 흡수되는 것)를 조사합니다. 이전에는 치료 전에 종양 위치를 확인하기 위해 2차원적인 엑스선으로 골격 영상을 촬영했습니다. 대체로 종양의 위치는 일정하기 때문에 이 같은 조회 방식으로 충분하지만, 종양이 움직일 가능성이 있는 경우엔 골격 촬영 대신 종양과 그 주위 정상 연부조직(soft tissue, 장기와 근육)을 포함하는 조직의 위치를 확인할 필요가 있습니다. 전립선암의 경우, 치료 중에 1~2cm 정도 움직일 수 있으므로 치료 전에 초음파나 전산화단층촬영(CT)으로 위치를 확인한 후 보정함으로써 정확도를 높일 수 있습니다. 이를 위해 개발된 방법이 영상유도 방사선치료(image-guided radiation therapy, IGRT)이며, 대개는 선형가속기에 CT 영상장치를 부착하거나 토모치료(tomotherapy) 장치를 사용합니다. 토모치료기는 고에너지 엑스선을 이용한 세기조절 방사선치료기와 전산화단층촬영기를 결합한 것입니다.
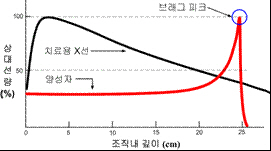
양성자치료
고에너지 엑스선을 사용하는 기존의 방사선치료는 방사선 통과 경로에 있는 암 전후방의 모든 조직에 손상을 주며, 특히 표피 가까이 있는 정상 세포가 암세포보다 훨씬 많이 손상됩니다. 엑스선의 이런 한계를 극복하기 위해 질량을 가진 입자(수소, 헬륨, 탄소, 네온 등의 핵)를 가속하여 암 치료에 이용하는 것을 입자 방사선치료라고 합니다. 입자 방사선은 물질을 통과하는 초기에는 방사선을 거의 방출하지 않다가 입자의 속도가 점점 줄어 정지할 무렵에 대부분의 방사선(80%)을 방출하고 멈추며, 따라서 그 후방에서는 방사선 노출이 없다는 것이 특징입니다. 이 방출 정점(頂點)을 브래그 피크(Bragg peak)라고 합니다.
여기에 사용되는 여러 입자 중 가장 가벼운 수소의 핵(양성자)을 가속하여 암 치료에 사용하는 것이 양성자치료(proton beam therapy, proton therapy)입니다. 다른 입자선에 비해 2차 방사선 오염이 적어 가장 깨끗한 선량 분포를 나타내는 장점이 있습니다. 전립선암 유병률이 높은 미국에서는 양성자치료가 이 질환에 가장 많이 쓰이며, 국내에서도 2007년부터 임상에 적용하고 있습니다.
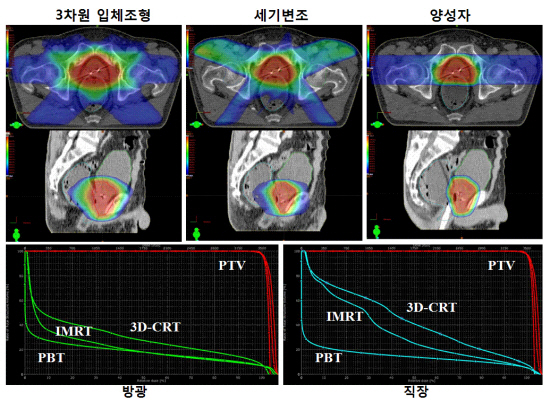
이들 방사선요법을 전립선암 환자에게 적용했을 때의 종류별 선량 분포와 주위 장기의 선량체적 히스토그램(dose-volume histogram)을 예시하겠습니다. 3차원 입체조형이나 세기변조 방식에 비해 양성자치료 시에 좌우 양측의 단순한 치료 계획에도 불구하고 직장과 방광에 가는 선량이 훨씬 적다는 것을 알 수 있습니다.
그림설명: 위에서부터 CT 단면 및 측면 영상과 주위 장기의 선량체적 히스토그램. 표적 체적(planning target volume, PTV)에 같은 처방 선량이 조사되는 동안 주위의 정상 조직(방광과 직장)에 투입되는 방사선량을 선량(x축)-체적(y축) 히스토그램에 도시했습니다. 주위 조직에 가는 양이 3차원 입체조형-세기변조-양성자치료의 순으로 감소됨을 알 수 있습니다.
② 조직 내 근접 치료(interstitial brachytherapy)
방사성 동위원소를 종양 부위에 직접 삽입하거나 접촉시켜서 치료하는 방법을 근접 방사선치료라고 합니다. 이중 직접 삽입하는 것이 조직 내 근접 치료입니다. 근접 치료의 장점은 정상 조직의 방사선 노출을 피하면서 종양에 많은 방사선을 조사할 수 있다는 것입니다. 전립선암에서 조직 내 근접 치료는 저선량 동위원소(방사성 옥소-125 또는 팔라듐-103 등)를 영구적으로 전립선에 삽입하는 방법(seed implantation, 자입치료)과 한시적으로 도관을 넣은 후 그리로 고선량 동위원소(이리듐-192)를 통과시켜 치료하는 방법이 있습니다. 앞의 방법은 주로 저위험군에서 수술이나 외부 방사선치료 대신 단독으로 쓰이고, 뒤의 것은 중등도 이상의 위험군에서 외부 방사선치료와 병행하는 경우가 많습니다.
방사선치료의 결과
암 치료의 궁극적인 목적은 암으로 인한 사망을 줄여 생존율을 높이는 데 있습니다. 전립선암 환자는 대개 오래 생존하므로 치료 효과를 판정하기 위해서는 10년 이상의 장기 관찰이 요구됩니다. 하지만 임상 연구에서 10년 이상을 관찰하여 생존율을 비교하는 것은 현실적으로 어렵기 때문에, 그 대신 생화학적 무병생존율(biochemical relapse-free survival, bRFS)을 비교하는 방법을 많이 씁니다. 이 개념에서 무병(無病)이란 ‘생화학적 실패(biochemical failure)’가 없는 것을 말합니다. 단, 생화학적 실패 후 임상적으로 재발이 관찰되기까지는 수십 개월이 걸리고, 대개 구제 호르몬요법이 시행되므로 bRFS과 생존율이 반드시 직접 연관되지는 않습니다. 생화학적 실패는 다음과 같이 정의됩니다.
- 미국 방사선종양학회(American Society for Radiation Oncology, ASTRO)의 정의(1996): 치료 후 추적검사에서 혈중 전립선특이항원(PSA) 수치가 3회 연속 상승한 경우이고, 첫 번째 상승 시점과 바로 전 검사 시점의 중간을 실패 시점으로 정의합니다.
- RTOG(Radiation Therapy Oncology Group)와 ASTRO가 주최한 피닉스 회의(Phoenix Consensus Conference)에서 수정된 정의(2005): 치료 후 추적 검사에서 PSA 수치가 최저점으로 떨어졌다가 다시 증가하여 그 수치가 최저치 +2.0ng/ml에 도달하는 경우이고, 이 시점을 실패 시점으로 정의합니다. (1ng 즉 1 나노그램은 10억분의 1 그램입니다.)
보고에 따라 전체 선량, 분할 선량, 호르몬치료의 유무, 추적 기간 등에서 차이는 있지만 5년 bRFS이 저위험군에서 94~96%, 중위험군 82~88%, 고위험군은 65~72% 정도입니다. 그리고 중등도 이하의 위험군에서 종양특이생존율이 96% 이상으로, 방사선치료 후 전립선암으로 사망할 확률은 4% 이하입니다. 하지만 고위험군의 종양특이생존율은 84~92% 정도여서 암으로 인한 사망률이 많게는 16%까지 관찰되는데, 여기에는 남성호르몬 제거치료(androgen deprivation therapy, ADT) 등 지속적인 보조요법이 도움이 될 수 있습니다.
수술 후 방사선치료
전립선의 절제 즉 적출은 완치를 목표로 하지만, 수술 후 재발하는 수가 적지 않습니다. 이런 경우, 영상의학적으로 재발 병소가 확인되기 전에 대개 전립선특이항원(PSA) 수치가 상승하는 생화학적 실패가 나타납니다. 생화학적 실패의 위험도는 암의 병기, 치료 전의 혈중 전립선특이항원(iPSA) 수치, 글리슨 점수(GS), 종양의 전립선 피막 또는 절제연(절제 부분의 가장자리, 즉 절제면) 침범 여부와 관련이 있습니다. 외국의 한 연구에 따르면 침범 여부 검사에서 피막과 절제연 모두 음성이었을 때의 치료 후 10년간 생화학적 실패율은 19%, 피막 음성에 절제연 양성이었을 때는 39%, 절제연 음성과 피막 양성이면 54%, 피막과 절제연 모두 양성이면 75%였습니다.
생화학적 실패에 대해 정립된 치료는 없습니다. 특정한 실패의 원인이 국소 재발 때문인지 아니면 림프절이나 원격 장기로의 미세 전이 때문인지를 구별하기가 쉽지 않기 때문입니다. 생화학적 실패 후의 진행 경로도 매우 다양해서, 어떤 환자는 원격전이로 진행하는 반면 다른 환자는 한동안 잠복 상태를 유지하기도 합니다. 따라서 대응 방법 역시 관찰요법에서부터 호르몬치료, 구제 방사선치료까지 다양하나, 완치 목적으로는 구제 방사선치료가 사용돼 왔습니다. 미국의 부어지언(S. Boorjian) 등은 생화학적 실패를 보인 2,657명 환자의 구제 방사선치료 결과를 발표했는데, 이 치료를 받지 않은 환자군에 비해 국소재발율이 90% 감소했으며, 호르몬치료의 필요성이 20%, 원격전이율은 75%가 줄었다고 합니다. 하지만 구제 방사선치료가 생존율 향상에도 기여한다는 증거는 없습니다.
방사선치료는 방광과 요로 기능의 회복에 지장을 주므로 수술 후 방광 기능에 문제가 생긴 환자는 그 기능이 회복된 후에 치료를 시작하는 것이 좋습니다.
고식적 방사선치료
이것은 증상 완화를 목적으로 하는 방사선치료입니다.
전립선암은 진단 당시 이미 3분의 1에서 원격전이를 보입니다. 수술이나 방사선치료 후의 재발 시에는 뼈로의 원격전이가 가장 흔하며, 이로 인한 통증이 특히 문제가 됩니다. 10~15%의 환자는 림프절, 폐, 간과 같은 연부조직에서 병변을 보입니다.
골반부 내의 광범위한 침윤으로 인해 골반부 통증, 혈뇨, 요도 압박, 하지부종(下肢浮腫, 다리가 붓는 것) 등이 있을 때에는 60Gy 정도의 외부 방사선을 조사하면 증상을 효과적으로 완화할 수 있습니다. 골 전이로 인한 통증의 경우에는 2~3주에 걸쳐 30~40Gy의 방사선을 조사하면 70~80%에서 완화를 기대할 수 있습니다.
냉동치료
냉동치료는 처음 소개된 후 여러 문제점 때문에 외면 받다가 최근 기구들이 발달하면서 다시 쓰이는 치료법으로, 초음파검사의 도움 아래 전립선암 부위에 냉동 주사침을 삽입한 후 암 조직을 저온으로 냉각시켜서 죽이는 것입니다. 개량된 제3세대 냉동치료법에서는 경(經)직장 초음파(직장을 통해서 실시)와 미세 냉동 바늘을 이용하여 보다 정밀하게 전립선 내에 냉동가스를 주입합니다.
과거에는 냉동치료를 하다가 요도나 직장이 손상되어 합병증이 생기는 수가 많았는데, 최근에는 요도 항온 장치와 직장 및 요도 괄약근의 자동 온도감지기를 이용해 합병증을 현저히 줄이고 치료 효과를 높였습니다. 냉동치료는 국소 전립선암뿐 아니라 국소 진행성 전립선암에도 적용이 가능하며, 방사선치료 후 재발한 국소 전립선암 환자에게도 효과적이고 안전한 치료법으로 기대되고 있습니다.
냉동치료의 장점은 병원 체류 기간이 짧고 복부를 절개할 필요가 없다는 것입니다. 이 요법의 지지자들은 과정이 간단하고 합병증도 적다는 점을 강조합니다.
합병증으로는 스트레스성 요실금, 직장과 요도 손상(직장과 회음부 사이의 누공 즉 샛길 포함) 등이 올 수 있으며, 다른 국소 치료에 비해 발기부전이 약간 많이 나타납니다. 이는 냉동치료에서 더 나은 치료 효과를 위해 냉동 강도를 높일 경우에 전립선 피막을 포함한 주위 조직까지 동결되기 때문으로 생각됩니다.
또 한 가지 유의할 것은, 전립선암은 보통 전립선의 여러 부분에서 동시에 자라나는 성질이 있다는 점입니다. 따라서 완전히 치료하려면 전립선 전체를 제거해야 합니다. 그러나 냉동요법만으로는 그럴 수가 없습니다. 요도 주변의 조직은 열로 보호해야 하는데, 그러면 가까이 있는 암 조직도 살아날 가능성이 있습니다.
열치료
열치료는 열을 이용해서 전립선 조직을 괴사시키는 방법으로 본디 전립선비대증 치료에 흔히 쓰이는데, 이를 일부 전립선암에 적용하기도 합니다. 열치료는 목표하는 조직에만 집중해서 손상을 줄 수 있으므로 열에 의한 직장이나 요도의 피해가 적습니다. 그러나 가끔 전립선 외측 부위에 죽지 않은 전립선 암 조직이 남을 수 있습니다. 합병증은 드물지만 직장루(직장 주위의 염증 등으로 인한 고름집 따위가 터져서 직장에서 고름 구멍이 열린 항문 샛길)나 요실금, 직장 점막 손상 등이 발생하기도 합니다.
적극적 관찰요법
80세 이상 고령인 사람에게서 천천히 자라는 전립선암이 초기에 발견된 경우에는 치료를 당장 시작하는 것이 불필요할 수도 있습니다. 이럴 때는 적극적 관찰요법을 씁니다. 주기적인 검사를 통해 병의 진행을 면밀히 관찰하는 것으로, 검사 결과에 따라 치료를 시작하게 됩니다. 대기관찰은 다른 중한 질환이 있는 환자에게도 적용할 수 있습니다. 그러나 10년 이상의 생존이 기대되며 분화도가 나쁜 전립선암을 가진 환자에게는 적절한 치료법이 못 됩니다.
적극적 관찰요법의 장점은 생활 방식의 변화가 없고, 치료를 하지 않으므로 부작용도 없다는 점이며, 단점으로는 전립선암이 진행할 가능성이 있습니다.
국소적으로 진행된 전립선암의 치료
국소적으로 진행된 전립선암이란 림프절이나 다른 부위로의 임상적 전이는 없으나 암세포가 전립선 피막을 벗어난 경우를 뜻합니다. 병기로는 T3에 해당합니다. 이러한 경우에 어떤 치료법이 가장 좋은지에 대해서는 지금까지도 논란이 있습니다.
수술적 치료, 방사선치료, 호르몬치료 중 어느 방법도 단독으로는 좋은 결과를 얻기 어렵습니다. 전립선 피막을 벗어난 전립선암은 림프절 전이 가능성이 31~48%나 되고 수술 후에도 종양이 남아 있을 가능성이 높기 때문에, 가장 많이 이용되는 치료법은 방사선치료입니다. 특히 방사선치료 전후에 보조적으로 호르몬치료도 하는 것이 효과가 더 좋습니다. 그러나 호르몬치료를 언제 시작하고 언제까지 해야 하는지는 정확히 밝혀져 있지 않습니다. 또한 국소적으로 진행된 전립선암의 일부는 수술적 치료로 좋은 결과를 보이기도 합니다.
ADT 병용 요법
국소적으로 진행된 전립선암, 또는 전립선에 국한되어 있더라도 고위험군인 경우에는 방사선 단독 치료보다는 호르몬치료와 병행하는 것이 권장됩니다. 방사선치료에 관한 RTOG의 연구에서 고위험군(T3 이상 또는 림프절 전이, 수술 환자 포함) 환자 977명을 대상으로 수술 후 고세렐린(goserelin)을 이용한 보조적인 남성호르몬 제거치료(androgen deprivation therapy, ADT)를 병용한 경우와와 재발 시의 ADT 사용을 비교한 결과 보조적 ADT를 실시한 집단에서 국소 제어율 향상, 원격전이율 감소, bRFS 향상의 결과를 보였습니다. 생존율, 종양특이생존율에는 큰 차이가 없었지만 GS 8~10인 환자에서는 생존율과 종양특이생존율에서도 유의미한 차이를 보여, 이 그룹에서는 보조적 ADT를 고려하는 것이 적절하다고 생각됩니다. EORTC(European Organization for Research and Treatment of Cancer)의 연구에서도 고위험군(WHO grade 3 또는 T3-4N0-1M0) 412명을 대상으로 방사선치료만을 시행한 집단과 3년간 ADT를 병용한 집단을 비교한 결과, ADT 병용군에서 5년 무병생존율(74% 대 40%)과 생존율(78% 대 62%)이 모두 높았다고 합니다. 요약하면 RTOG 결과는 GS 8~10인 환자에서, EORTC 결과는 WHO(세계보건기구) 등급 3 또는 병기 T3-4N0-1M0 환자에서 장기(2년 이상)의 보조적 ADT가 생존율 향상에 기여하는 것으로 보고하고 있습니다. 최근에는 전이 전립선암에서도 ADT치료의 효과가 입증되어 전이 환자에서도 사용합니다.
전이 전립선암의 치료
전이 전립선암이란 암이 전립선을 벗어나 주위 장기 또는 림프절, 뼈, 폐 등으로 퍼져서 완치할 수 없는 암으로 진행한 경우를 말합니다. 이에 대한 대표적인 치료법은 남성호르몬을 박탈하는 호르몬치료입니다.
호르몬 치료
남성호르몬은 전립선 암세포의 성장을 촉진합니다. 따라서 이 호르몬의 생성을 차단하거나 기능을 억제하면 치료 초기에는 암의 진행을 막거나 속도를 늦출 수 있습니다. 그러나 호르몬치료가 전립선암을 완치시키는 것은 아닙니다.
호르몬치료의 종류로는, 남성호르몬을 생산하는 고환을 수술로 제거하는 고환 적출술, 약물로 고환 적출과 같은 효과를 얻는 황체형성호르몬 방출호르몬(luteinizing hormone-releasing hormone, LHRH) 촉진제 투여, 에스트로겐 제제 투여, 항(抗)남성호르몬 제제 투여 등이 있습니다. 부작용은 안면 홍조, 발기부전, 성욕 감퇴, 여성형 유방, 뼈의 약화 등입니다. 황체형성호르몬이란 뇌하수체 전엽에서 분비되는 생식샘 자극호르몬으로, 여성의 배란 및 황체 형성을 촉진하고 남성에서는 고환을 자극하여 남성호르몬의 분비를 돕습니다. 황체는 난소에서 난자가 배출된 뒤에 난소의 소포가 변하여 생기는 황색의 조직 덩어리이며, 황체호르몬 즉 프로게스테론을 분비하여 임신 유지를 돕습니다.
대부분의 전이 전립선암은 처음엔 호르몬치료를 잘 받아들이는 호르몬 수용성(또는 의존성) 전립선암(hormone sensitive prostate cancer, HSPC)으로 80~90%의 높은 반응률을 보입니다.
하지만 평균 18~24개월 후에는 재발하여 남성호르몬 저항 (또는 비의존성) 상태로 진행됩니다 (castration resistant prostate cancer, CRPC). 혈중 전립선특이항원(PSA) 수치가 상승하고, 남성 호르몬 수치가 거세 수준인 50ng/mL미만상태에서 영상검사에서도 재발이 보이기 시작하면서 통증 등의 증상이 나타나는 진행성 거세 저항성 상태로 발전해 3~4년 내에 사망하게 됩니다. 결국 전립선암으로 인한 사망은 모두 거세 저항성 전립선암(castration resistant prostate cancer, CRPC)으로 진행함으로써 발생한다고 해도 과언이 아닙니다.
이러한 경우 현재 나와 있는 치료법들은 효과가 미흡하고 평균 생존 기간도 40~60주에 불과해, 통증을 완화하고 삶의 질을 조금이라도 낫게 해주는 치료가 주로 시행됩니다. 진통제 투여, 항암제 사용, 통증이 심한 전이 부위에 대한 방사선치료, 골 전이에 대한 약물 투여(스트론튬-89에 의한 통증 완화 포함) 등이 있습니다.
최근 들어서는 전립선암의 표적 호르몬 수용체를 찾아내어 전립선암 세포에 특이적으로 공격하는 2차 호르몬 치료제들이 개발되어 임상에서 사용되고 있으며 (우리나라는 enzalutamide, abiraterone acetate가 보험 인정이 됨) 그 이외에도 표적치료와 면역치료 같은 시험적인 요법들도 임상시험에 도입되고 있습니다. 이처럼 거세 저항성 전립선암 환자들에게 효과적인 치료법의 개발이 절실하기 때문에 전 세계적으로 활발한 연구가 이루어지고 있습니다.
외과적 거세
고환 적출술
고환 적출술(orchiectomy)은 말기 전립선암의 기본 치료로서, 고환에서 생산되는 남성호르몬을 가장 손쉽고 빠르게 제거하는 방법입니다. 이를 통해 혈중 테스토스테론의 90~95%가 제거되며, 효과가 빨라서 골(뼈) 동통(疼痛, 쑤시고 아픔) 등의 증상이 즉시 완화되는 장점이 있습니다. 부작용은 거의 없으나 얼굴이 화끈거리는 안면 홍조, 성욕 감퇴, 발기부전 등이 나타날 수 있고, 외과적 거세에 따른 정신적 충격이 있을 수 있습니다.
내과적 거세
내과적 거세란 여성호르몬, 황체형성호르몬 방출호르몬(LHRH) 촉진제 등을 투여하여 뇌하수체의 성선자극호르몬 분비를 억제함으로써 테스토스테론의 생성을 방해하는 것입니다.
황체형성호르몬 방출호르몬 촉진제
황체형성호르몬 방출호르몬(LHRH) 촉진제는 뇌하수체에 작용하여 처음에는 황체(黃體)호르몬의 분비를 촉진하지만 계속 투여하면 뇌하수체의 LHRH 수용체에 변형이 일어나 황체호르몬 분비를 억제하게 되고, 결국 테스토스테론의 생성도 억제되어 2주 이내에 외과적 거세에 의한 수준에까지 도달합니다. 촉진제를 투여하는 초기 1~2주 사이에 황체호르몬 분비가 증가해 전립선암의 증상들이 오히려 악화되는 것을 ‘확대 현상’이라고 합니다. 확대 현상은 항남성호르몬 제제나 에스트로겐 따위를 같이 투여하면 예방할 수 있습니다. 특히 종양이 커서 척수 압박, 요관 폐색의 위험이 있거나 암으로 인한 증상이 매우 심한 환자들에게 LHRH 촉진제를 투여할 때는 확대 현상 예방 치료를 꼭 고려해야 합니다.
에스트로겐
에스트로겐 즉 소포호르몬은 뇌하수체에서 황체호르몬의 분비를 억제하여 혈중 테스토스테론을 감소시키는데, 전립선암 치료를 위해 가장 많이 이용되는 것은 디에틸스틸베스테롤(diethylstilbestrol, DES)이라는 합성 에스트로겐입니다. 이것을 매일 3~5mg씩 경구 투여하면 혈중 테스토스테론 수치를 거의 거세 수준까지 낮출 수 있습니다. 그러나 심혈관계 부작용이 오고 유방이 여성처럼 변할 수 있어 현재는 거의 사용하지 않습니다.
항남성호르몬 제제
항(抗)남성호르몬 제제는 테스토스테론이나 디하이드로테스토스테론(Dihydrotestosterone, DHT)이 남성호르몬 수용체와 결합하는 것을 방해하여 결과적으로 남성호르몬의 작용을 억제합니다. 경구로 투여하며 분자 구조에 따라 스테로이드성과 비스테로이드성 제제로 나뉩니다.
스테로이드성 항남성호르몬 제제는 남성호르몬 수용체도 차단하지만 프로게스테론 즉 황체호르몬과 구조가 비슷하기 때문에 뇌하수체의 황체호르몬 분비를 줄이며, 결국 테스토스테론의 생성과 활성을 감소시킵니다. 한편 비스테로이드성 항남성호르몬 제제는 세포의 핵에 결합된 남성호르몬 수용체를 차단함으로써 테스토스테론이나 디하이드로테스토스테론의 세포 내 활성을 억제합니다. 그런데 이 제제는 전립선뿐 아니라 시상하부-뇌하수체 축의 수용체에도 작용하여 혈중 테스토스테론의 음성 되먹임(negative feedback) 기전을 차단하기 때문에 황체형성호르몬 방출호르몬의 생성을 늘리고, 결과적으로 혈중 황체호르몬과 테스토스테론을 증가시킵니다. 따라서 성욕과 성기능을 유지시킨다는 임상적 장점이 있습니다.
거세 저항성 전립선암의 치료
전립선암 환자에게 호르몬치료를 계속하면 결국에는 호르몬에 반응하지 않는 암세포만 살아남아 거세 저항성 전립선암으로 진행하게 됩니다. 이 단계가 되면 생존 기간이 2~3년에 불과하고, 어떤 치료도 생존율을 높이지 못합니다. 따라서 이때부터는 항암제 등을 투여하면서 병의 진행을 늦추고, 통증을 완화하여 삶의 질을 유지시키는 것이 치료의 목적입니다.
호르몬 불응성이라 해도 치료에 불응한다는 것이지 남성호르몬에 노출되면 병이 더 심하게 진행될 수 있으니 남성호르몬을 계속 거세 수준으로 유지해야 합니다. 즉, 호르몬치료를 계속해야 합니다.
2020년, 한국 보험 약제들
| 암 상태 | 약제 종류 | 암 상태 | 약제 종류 |
|---|---|---|---|
| 전이 호르몬 수용성 전립선암 |
|
비전이 거세 저항성 전립선암 |
|
| 전이 거세 저항성 전립선암 |
|
유전성 전이 전립선암 |
|
항암화학요법
항암화학요법, 속칭 항암치료의 부작용은 호르몬치료에 비해 심한 편입니다. 최근에는 탁솔(taxol)계의 항암제를 기본으로 한 병용치료가 전립선암의 생존율을 높인다는 결과가 보고되어 전이를 동반한 거세 저항성 전립선암의 표준치료로 쓰이고 있습니다. 최근에는 호르몬 수용성 전립선암에도 항암치료와 호르몬치료 병합요법이 사용되고 있습니다.
방사선 치료
뼈나 림프절 등 전이 부위의 통증이 심할 때 방사선치료를 하면 환자의 약 80%에서 진통 효과가 있습니다. 다발성 전이 때문에 진통제도 효과가 없을 만큼 전신 통증이 심하면 전신 방사선치료를 시행하기도 하고, 방사성 동위원소인 스트론튬(strontium)을 투여해 효과를 보기도 합니다.
골 전이 치료
골 전이(뼈 전이)가 있는 전립선암의 치료 목표는 통증 감소와 병적 골절의 예방, 기동성과 기능의 향상에 있으며, 골 전이 환자의 80%에서 남성호르몬 차단만으로 증상이 호전됩니다. 골 전이에 의한 합병증은 척수 압박, 병적인 척추 압박 골절과 장골(腸骨, 엉덩뼈) 골절, 고칼슘 혈증, 골수 부전 등이 있습니다.
척수 압박은 발현 당시의 상태가 치료 결과와 밀접한 관계가 있으므로 조기 발견이 중요합니다. 대체로 방사선치료를 하고, 수술은 처음 치료로 효과가 없거나 뼈에 불안정성이 있는 경우에 시행합니다. 병적 골절은 늑골(갈비뼈), 골반, 견갑골(肩胛骨, 어깨뼈), 척추에 잘 생기며, 장골(엉덩뼈) 골절은 가능하면 수술적으로 치료하는 것이 가장 좋습니다.
골 전이로 인한 통증이 남성호르몬 억제요법으로 호전되지 않을 때는 방사선치료를 해볼 수 있습니다. 전이된 곳이 많다면 치료 영역을 조절하여 실시합니다. 방사선치료를 하면 수일 내에 70%의 환자에서 통증이 감소됩니다. 다발성 골 전이의 경우에는 골 친화성 방사성 동위원소인 스트론튬을 이용하는데, 75%의 환자에서 치료 2~4주 내에 통증이 줄어듭니다. 이런 방법으로 통증이 조절되지 않는다면 비스테로이드성 소염제로 시작하는 진통제 치료로 넘어갑니다.
비뇨기계 증상 치료
요폐(尿閉, 요도가 막혀서 오줌이 잘 나오지 않는 것)와 혈뇨에는 각기 경(經)요도 전립선 절제술과 지혈을 시행하고, 요관의 폐색에 대해서는 경피적으로 신루(腎瘻) 형성술(nephrostomy)을 시행하거나 내부에 스텐트(stent) 즉 요관 부목을 넣어 소변의 통로를 확보할 수 있습니다. 신루 형성술(신루 설치술, 신루술)이란 환자의 체외에서 가는 관을 신장으로 넣어 소변을 배액시키는 시술입니다.
빈혈 치료
골 전이가 광범위한 환자에게는 빈혈도 발생합니다. 방사선치료나 남성호르몬 차단, 혈뇨 등에 의해 빈혈 증상이 심해질 수 있으므로 적절한 대응이 필요합니다.
식욕부진과 영양실조 치료
진행된 전립선암 환자의 절반 이상에서 식욕부진과 영양실조가 나타납니다. 적절한 영양 공급을 해야 하며, 식욕을 증진시키는 메게스트롤 아세테이트(megestrol acetate) 등의 약물을 사용할 수도 있습니다.
예방법
개요
전립선암의 주요 위험요인은 나이, 인종, 남성호르몬, 가족력, 비만, 그리고 직업 등으로 인한 유해물질에의 장기 노출 등인데, 이 가운데 나이와 인종은 바꿀 수 없지만, 나머지 요인들을 적절히 관리하면 전립선암 발생 가능성을 줄일 수 있습니다.
적정 체중 유지
과체중이거나 비만하면 전립선암 발생 위험이 높아지므로, 식이 조절과 적절한 운동을 통해 알맞은 체중을 유지하는 것이 필요합니다.
직업 관련 유해물질에 대한 노출 최소화
농약, 코크스, 유기용제, 방사성물질, 금속성 먼지 등 유해물질에 상시로 노출되는 직업, 신체 활동이 적은 직업, 전신에 진동이 전달되는 직업 등에 종사하는 근로자에게서 전립선암 발생이 증가하는 경향이 있습니다. 작업장의 보건 안전수칙을 철저히 지키고 유해물질에 노출되는 것을 최소화하기 위한 노력이 필요합니다.
음식 조절을 통한 예방
식생활과 영양이 전립선암과 관계가 깊다는 사실은 잘 알려져 있습니다. 에너지 섭취량 중 지방이 큰 비중을 차지하는 서구에서 아시아보다 전립선암이 많이 발생하는데, 특히 동물성 지방이 전립선암 발병에 중요한 역할을 하는 것으로 생각됩니다. 다른 식품이나 성분과의 관계는 뚜렷이 밝혀진 것이 별로 없지만, 미세영양소(micronutrient)라 불리는 여러 가지 성분이 항산화제 역할을 함으로써 암 예방에 기여하는 것으로 알려졌습니다. 미세영양소란 단백질과 지방, 탄수화물처럼 대량으로 필요한 거대영양소(macronutrient)와 달리 아주 적은 양만 섭취해도 충분한 물질을 말하며, 비타민과 칼슘‧마그네슘‧셀레늄 같은 무기질도 이에 속합니다.
알파 토코페롤(alpha-Tocopherol)은 흡연자들의 전립선암 예방에 기여하며, 토마토에 많은 성분인 라이코펜(lycopene), 미량원소 셀레늄(selenium), 콩에 많은 제니스테인(genistein) 등도 전립선암 예방에 도움이 된다고 합니다. 녹차, 레티노산(retinoic acid), 비스테로이드성 항염제 따위 역시 전립선암 억제 효과가 있는 것으로 보고되었습니다.
일반적으로 말해, 동물성 지방이 많은 육류를 적게 먹고 섬유질이 많은 음식, 신선한 과일과 야채, 콩류 등을 적절히 섭취하는 것이 전립선암의 예방에 좋다 하겠습니다.
빨간 토마토와 노란 카레
전립선암의 위험을 낮추는 대표적인 성분은 라이코펜입니다. 라이코펜은 토마토, 수박 등에 들어 있는 빨간 색소로, 강력한 항산화(세포의 산화를 억제하는 것) 작용을 함으로써 암이 발생할 가능성을 줄입니다. 미국에서 4만 8,000명의 의사들이 6년간 실시한 실험에 의하면 토마토가 많이 들어간 음식을 먹은 사람은 전립선암의 발병률이 20% 감소했으며, 이를 일주일에 10회 이상 먹은 사람은 발병률이 절반으로 줄었습니다. 잘 알다시피 서양에서는 샐러드 조리에 토마토가 빠지지 않고, 이탈리아에서는 토마토가 정력제라며 많은 양을 섭취합니다.
가공식품은 설탕과 각종 첨가물이 들어가기 때문에 몸의 균형을 깨고 암을 유발하는 등 문제를 일으킬 소지가 크다고 흔히들 이야기합니다. 하지만 토마토는 그렇지 않아서, 가공한 것이 날것보다 항암 효과가 큽니다. 라이코펜은 완숙한 토마토에 더 풍부한데 시중의 토마토 가공식품들은 완숙 토마토로 만들기 때문입니다. 따라서 가공된 케첩이나 토마토소스 따위에 항암 성분이 더 많습니다. 라이코펜 함량이 가장 많은 것은 토마토 페이스트로 100g당 55.5mg이며 그다음이 토마토소스와 토마토케첩, 토마토퓌레(토마토를 으깨어 걸러서 농축한 것), 스파게티 소스, 토마토주스, 그냥 토마토의 순입니다.
아울러, 카레의 노란 색소로 사용되는 커큐민(curcumin)이라는 물질도 전립선암의 발생과 전이를 막는 데 효과적이라는 동물 실험 결과가 새롭게 발표되었습니다. 커큐민은 인도가 원산지인 다년생 식물 강황(薑黃)에 들어 있는 성분으로 주로 카레와 겨자 등의 색소로 이용됩니다.
비타민과 미네랄, 셀레늄
비타민과 미네랄(인체의 생리 기능에 필요한 칼륨, 나트륨, 칼슘, 인, 철 따위 광물성 영양소)도 전립선암의 위험을 감소시킨다고 하는데, 아직은 명확한 증거가 없습니다. 하루 50mg의 비타민 E(토코페롤)를 섭취하면 암 예방 효과가 있다는 연구 결과가 나와 있으나, 다른 연구에서는 전립선암 예방 효과가 없고 오히려 심장 질환을 증가시킬 수 있으니 좋지 않다고 했습니다.
셀레늄은 사람과 동물에게 필수적인 무기질 영양소로 전 세계의 토양에 분포돼 있는데 전립선암 발생 위험을 낮춰 준다고 합니다. 비타민 A가 결핍되면 전립선암 발생 확률이 높아진다고도 하는데, 다른 연구에서는 비타민 A의 과다 투여가 전립선암의 위험을 늘린다고 했습니다. 연구 결과들이 서로 엇갈리는 만큼, 이러한 제제들을 복용할 때는 반드시 의사와 상의해야 합니다.
비타민 D는 암을 예방한다고 알려져 있습니다. 우리는 음식과 햇빛에서 비타민 D를 공급받습니다. 피부가 햇빛에 노출되면 콜레스테롤로부터 비타민 D가 합성되고, 신장에서 활성화된 형태로 바뀝니다. 여기서 중요한 것은 활성화된 비타민 D가 세포의 정상적 분화를 돕는다는 점, 다시 말해 세포가 원형을 유지하면서 질서 있게 성장하도록 해준다는 점입니다.
녹차
녹차의 항암 효과가 주목 받기 시작한 것은 1978년쯤입니다. 일본에서 시즈오카 현의 암 사망률이 전국 평균보다 현저히 낮게 나타나자 그 원인을 조사한 결과, 현 내에서도 특히 녹차 생산지의 위암 사망률이 다른 지역의 5분의 1 정도밖에 안 된다는 것이 밝혀졌습니다. 중국의 연구에서도 남성들이 녹차를 매일 마시면 전립선암에 걸릴 가능성을 3분의 2나 줄일 수 있으며, 마시는 녹차의 양이 많을수록, 마신 기간이 길수록 발병 위험이 더 감소하는 것으로 나타났습니다.
차의 중요한 기능성 성분은 폴리페놀성 화합물인 카테킨(catechin)류입니다. 씁쓸하고 떫은 맛을 내는 성분이 바로 이것인데, 항산화 기능이 탁월하고 항암과 항균 효과, 심장병 발생 억제 효과가 밝혀져 있습니다. 녹차에 10~18%가량 함유되었는데, 이는 찻잎을 발효하여 만드는 우롱차나 홍차에 비해 높은 함량입니다. 카테킨은 발효 과정에서 줄어들기 때문입니다.
콩 및 콩 가공식품
여러 역학 연구들에 따르면 콩을 많이 섭취하는 나라에서는 전립선암으로 사망하는 사람의 비율도 낮다고 합니다. 이는 콩 섭취 같은 식이(食餌) 요소가 전립선암 발생 여부 및 진행 과정과 중요한 관련이 있음을 보여주는 것인 만큼, 앞으로도 전립선암 치료제와 화학적 암 예방제로서 콩의 미래는 밝을 것으로 전망됩니다.
호르몬 조절에 의한 예방
남성호르몬 억제제는 주로 전립선비대증의 치료제로 사용되는데, 전립선암을 예방하는 효과도 있는 것으로 보고되었습니다. 그러나 여러 가지 부작용이 생길 수 있으니 반드시 의사의 처방을 받아 사용해야 합니다.
남성호르몬의 대사에 관여해 디하이드로테스토스테론(dihydrotestosterone, DHT)의 생성을 감소시키는 약물인 피나스테리드(finasteride)를 이용하는 방법, 전립선 조직의 증식에 관여하는 성장인자를 억제하는 방법 등이 연구되고 있습니다.